华夏源类器官:“再造自我”的类器官技术,将如何颠覆人类的未来?“
电影《复联4》中有一个经典的科幻桥段:超级反派人工智能奥创控制了遗传学家赵博士,在她的“再生摇篮”中通过人体细胞,打造了一个强大的机械生命体——幻视。这一看似匪夷所思、活在未来的“再生梦想”,现实中真的存在吗?
事实上随着生命科学的发展,基于干细胞自我复制与分化的万能特性,同时融合3D打印、基因、纳米等技术,人类重新修复、再造自我组织和器官的梦想已经照进现实。
现实版“幻视”——“类器官”的诞生开启了再造自我的可能。新世纪以来,这项新兴技术,已经越来越多地应用于包括疾病建模、发病机制、药物筛选、再生医学等多个领域,并率先为癌症的个体化与精准诊疗开辟了全新的通道。
今天的文章我们一起走进类器官及其产业化的故事。
上古传说中,神农氏炎帝的肚子玲珑剔透能够看见五脏六腑,凭借此天赋他得以根据观察草药在体内的运作情况来更好地了解药效和副作用。现实中,古代医生也以“神农尝百草”的方式亲身试药。
到公元8世纪,圈养的家禽家畜被选用为药物实验的替代对象。进入17世纪,以体型小、繁殖快、基因纯粹的小鼠为代表的动物模型逐渐成为人类“替身试药”的主要途径。

△ 在大量的动物实验探索中,小鼠是最常见的一种:等待药物实验的小鼠,正在接受呼吸麻醉
然而,许多在非临床研究中显示出令人满意结果的药物,在临床阶段却面临失败,动物数据无法完全转换为人类数据的瓶颈,构成了现代各类疾病新药研究和开发的重大局限。
直到1965年到1985年间,伴随PubMed 上搜索量的暴增,反映了细胞生物学领域的一个崭新概念——类器官(Organoid)在全球各大发育生物学的实验室里迎来首次流行,科学家们正试图通过细胞的解离和重聚,在器皿里呈现一种高度类似体内器官结构和功能的“微器官模型”。终于,人类药物筛选与研究的即将迎来一次历史性的转变。

△ 显微镜下科学家建立起来的类器官模型结构
(实心与松散状乳腺癌类器官生长6天视频记录)
这项最早尝试于20世纪初期的开创性研究的核心目标之一就是实现人类器官的重建,以帮助我们更准确地了解组织器官的发育以及生理病理发生的秘密,从而为找到克服万千疾病的方法创造一条全新的路径。
在此期间,从2D到3D培养基的转变,以及在培养基中完成对可再生干细胞复杂三维的培养构建,共同推动着类器官研究的进展。其中,1981年体外小鼠胚胎干细胞系(ESCs)的成功建立,算得上一个重要的里程碑。
作为干细胞家族迄今为止最为重要的分支之一,ESC 拥有出色的多向分化潜能和“发育全能性”,不仅能在体外长期增殖并始终保持高度未分化状态和进行遗传或转化。换句话说,这种无限增殖的特性,将构成培养出不同种类的类器官的先决条件。
但1998年起,从美国掀起的对人类胚胎干细胞(hESC)研究与应用的伦理道德的巨大争议,使一切与之相关的研究都陷入了一种引而不发的状态。直到2006年既“继承”了ESC的多能性,又打破了多能干细胞来源“不正当性”的诱导多能干细胞(iPSC)的出现,才再一次助力了类器官的技术复兴。

△ 2012年12月10日,“iPSC之父”山中伸弥在斯德哥尔摩音乐厅接受瑞典国王颁发的诺贝尔奖
01
全球首款类器官:
迷你肠道和它的开山鼻祖
2009年的某天,位于荷兰乌得勒支科技园的 Hubrecht Institute 研究所,经历近十年乏味的实验,分子遗传学教授汉斯·克莱弗斯(Hans Clevers)询问实验室博士后佐藤敏郎(Toshiro Sato):“进展如何,鉴定出肠道干细胞了吗?”
“是的,他们在这里。”

△ 肠道干细胞分化出的类器官染色
当 Clevers 看到 Sato 所展示的结果,他第一时间意识到这些经过 Matrigel 体系[1]培养扩增后的小鼠LGR5肠道团簇状干细胞,具备构建迷你肠道(mini-gut)的潜力,即它们可能拥有分化为全部肠上皮细胞类型的潜力。随后该实验小组继续跟踪并报告了多个其他人类和小鼠组织的类似结果,均表明该模型能够很好地模拟体内小肠的形态结构和功能。
这意味着LGR5+小肠干细胞成功培养出了世界上第一个真正的类器官——微型肠道类器官。
尽管在这之前,日本干细胞生物学家佐井佳彦(Yoshiki Sasai)等人曾利用 iPSC 和 ESC 开发建立了大脑皮层、视网膜等“器官样结构”的方法。但迷你肠道的诞生,是直接从解剖的成人组织碎片中获得的,包括病变患者组织。相较前者来源于多能干细胞(Pluripotent stem cell,PSC)定向分化所衍生的细胞仅适用于精神遗传病等发育生物学领域,后者则开辟了成体干细胞(Adult stem cell , ASC)所涉及的各种领域,如组织生物学、再生医学、转化医学等。

△ 成体干细胞长成类器官的过程
自肠道类器官起,科学家们备受启发相继从小鼠和人组织中顺利培育出包括脑、胰、肝、胃、肾等在内的多种类器官。作为隶属于活跃的国际研究社区的一所非盈利机构,2013年 Clevers 创立并领导的 Hubrecht Organoid Technology(HUB)实验室也因此成为全球类器官技术界的“独角兽”,Clevers 本人则被业界视为类器官“开山鼻祖”。
接下去的十年,他不仅致力于带领团队在全球范围内“推广”类器官的培养方法,还同时将自己的另一重身份定位于开发类器官应用价值的国际布道者。

△ 2017年,《Science》杂志称 Clevers 为类器官建筑师
最初,Clevers 团队认为类器官首先应当应用于再生医学领域的器官修复和移植。但由于往往缺乏血管系统和免疫细胞等微环境,在保证细胞不死亡的前提下,类器官正常生长的体积大小是有限的,暂时无法完美地满足替代人体器官的复杂需要。于是,Clevers 将方向调整为更有可能带去快速革新的疾病建模领域。
简单地讲,就是利用类器官来模拟和还原组织器官病变的过程,以更好地了解是哪些原因导致了疾病的发生,并有望作为患者的“替身”以评估和筛选潜在的、个体化的治疗方案。罕见病囊性纤维化 (CF)是 HUB 实验室运用类器官验证药物测试成效的典型案例。

△ 生物科技巨头福泰制药(Vertex Pharma)2012年推出的全球首款 CF 靶向治疗药 Ivacaftor 便得益于同 Clevers 团队的合作
当然更加顺理成章的是,作为最具大量未被满足的临床需求的领域之一,癌症正在迅速发展为类器官技术应用的热门地。
02
当肿瘤遇上类器官,
遐想中的“替身试药”照进现实
回顾过去几个世纪以来人类与癌症斗争的历史,不难发现近几十年凭借治疗手段的革新,生命科学正不断颠覆着癌症治疗的格局。从外科手术到放化疗,再到靶向药和免疫疗法,原本的不治之症在一定程度上得到了有效的控制,甚至给全球数千万患者带去被治愈的希望。
在这一巨大的历史进程里,还映射着我们对于癌症认知度的不断提升。即其不仅是一种基因疾病 (Genetic disease),还是一种免疫细胞无法识别和攻击恶性细胞的免疫性疾病 (Immunological disease),更是一种非单一的、动态的、显示出极高异质性(Heterogeneity)特征的疾病。

△ 类器官染色后呈现不同的细胞类型
也就是说,在不同的癌症患者之间、同一患者的不同肿瘤之间,甚至在同一肿瘤的内部都存在不同的特性。因此,即使今天的癌症治疗取得了质的飞跃,但依然没有一种“神药”能够治疗所有类型的癌症,或是完全挣脱癌症转移、扩散及耐药性的困境。这也是为什么,个性化的精准治疗越来越被提倡为未来癌症创新疗法的目标方向。
而精准治疗的一个必要基础便是建立足够有代表性的肿瘤临床前研究模型。
在类器官技术诞生以前,人源肿瘤异种移植(Patient-derived tumor xenograft,PDX)模型对于传统细胞系移植模型(Cell-derived xenograft, CDX)的迭代,对助力肿瘤精准治的创新研究发挥了至关重要的作用。

△ PDX、CDX模型流程对比
相较 CDX 模型需要进行肿瘤细胞系的人工纯化,PDX更为完整地保持了原发肿瘤的遗传特性和异质性,实验结果与临床的相似性更高
PDX 模型的主要原理是将来源于人类患者的肿瘤组织和原代细胞植入免疫缺陷的小鼠体内,达到再现人类肿瘤的目的。为研究肿瘤的机制、治疗和药物筛选提供了理想的动物模型。
约2005年,PDX 模型的建立就已趋向成熟,并逐渐被广泛用于全球范围内的癌症生物学研究,协助个性化癌症新药的筛选、药效评估、联合用试药、生物标记物研发等临床前试验。2014年10月,《Science》杂志封面的“广而告之”更是将PDX 模型的应用价值推上了高潮。
不过就在5年后,《Science》通过一期特刊“致敬”了类器官独一无二的前景。四篇重磅综述中,Clevers 等发表的一篇“当肿瘤遇上类器官”令全球有意布局精准医疗的生物科技公司热血沸腾。这款市场“兴奋剂”的名字便是,终于迎来华丽登场的肿瘤类器官 PDO(Patient Derived Organoid)。

△ 2019年6月7日,类器官荣登《Science》特刊封面
根据直译“源自患者的肿瘤模型”,PDO的定义可以进一步解释为:利用患者来源的肿瘤组织进行体外分离肿瘤细胞,并进行3D培养从而形成一个“迷你肿瘤”。其实早在2011年“迷你肠道”问世不久后,Clevers 团队就从结肠腺瘤样本中培养建立了结肠肿瘤类器官,开启了PDO 个性化治疗的新纪元。
那么 PDX 与 PDO 的差异究竟在哪,PDO 可以称之为 PDX 的升级版吗?

△ PDO流程,本质上:
PDO 相较 PDX 最大的不同在于其构建的是人类肿瘤器官模型
首先,通过肿瘤手术标本、穿刺标本等方式获取到的肿瘤干细胞(cancer stem cell)拥有强大的体外有序分化和更新为3D结构的能力,从而使得 PDO 的构建过程变得更高效(4-6周)、成功率更高且应用于临床的结果回报周期更短,有望为癌症患者在时间窗内提供个性化诊疗方案。
不仅如此,相较于PDX仅对恶性程度较高的肿瘤具备较高的移植成功率,PDO 既可以良好地浓缩恶性程度不同的各类原始肿瘤的诸多形态和分子生物学特征,模拟其生理和药敏特性,且基因稳定性、可修饰性更高。无论是对其进行多代培养还是基因编辑,都能保持其构建覆盖更广泛癌症生物样本库的可能,并赋予科研人员充分的操作自由度。
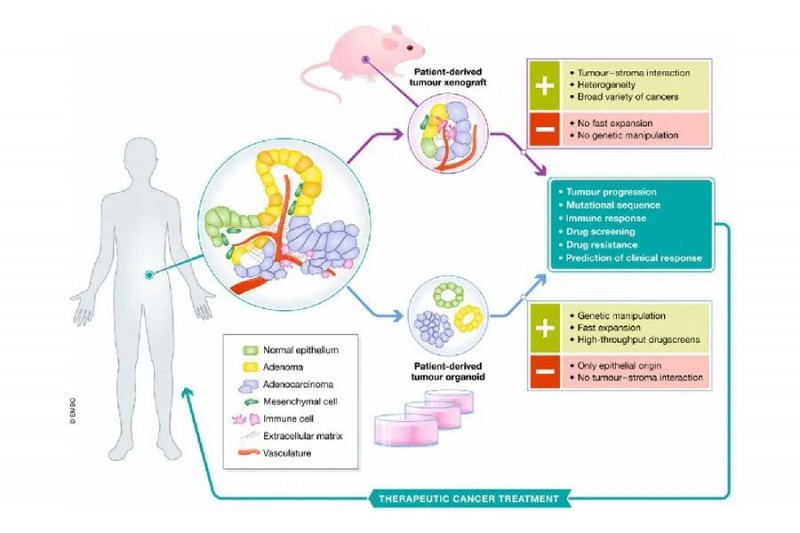
△ 相较PDX,PDO既可以良好地浓缩恶性程度不同的各类原始肿瘤的诸多形态和分子生物学特征,模拟其生理和药敏特性,且基因稳定性、可修饰性更高
更重要的是,越来越多的研究印证了PDO出色的药效预测性和药物筛选的高通量性。相关数据显示,PDO 具备100%的敏感性、93%的特异性和88%的阳性预测值。同时伴随液体处理和自动化培养水平的提升,PDO 可大大提升高通量药物筛的效率。
此外,有部分研究通过外周血单核细胞和胃肠道肿瘤类器官的共培养,成功地产生了肿瘤反应性 T 细胞,发现PDO可用于评估 T 细胞介导的肿瘤杀伤效率。意思是,PDO在免疫肿瘤学和液体活检中也颇具潜力,未来有希望改善传患者对传统侵入性活检的依从性。
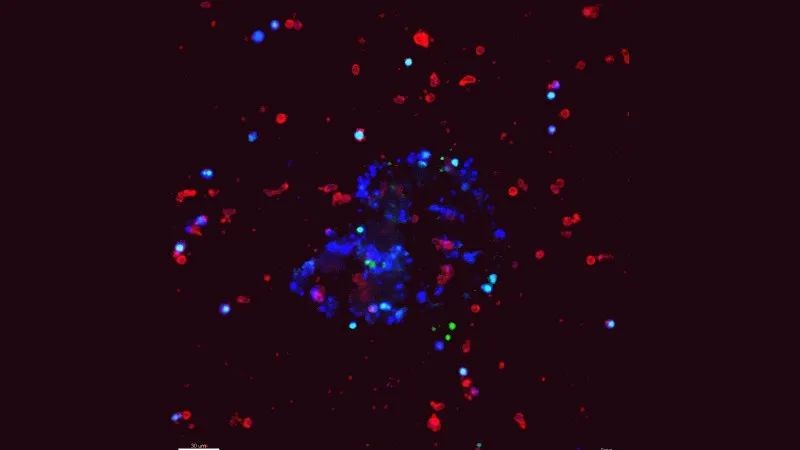
△ 肿瘤类器官与免疫细胞共培养:蓝色肿瘤类器官,红色NK细胞
总而言之,可以说横向上PDO兼具了CDX和 PDX 两种模型的优势,纵向上彰显着自身无限的待开发、可开发的空间。未来,它的价值绝非仅仅作为 PDX 的升级版而存在,而将会是生命科学领域用于识别、评估以及提高抗癌新药研发效率和疗效的新颖工具跟理想平台。
也因此,以PDO为代表的类器官技术正在勾画一副新产业的蓝图。医药巨头们渴望在此挖掘新一轮的业务增长点,新兴的生物科技公司则更加野心勃勃地希望通过布局先发优势,抓住一次缔造新历史的机会。
03
癌症之外,
类器官在诸多领域大有可为
只不过在一切的商业企图心落地现实之前,产业崛起之初的风向标往往取决于:手握技术密码的人去了哪里、做了什么,以及哪些因素共同催化了技术商业化、产业化的进度条和可能性。
以Clevers为中心,我们不妨先来厘清迄今类器官研究领域的几位“大牛”及其间的人物关系。2009年以一作身份在《Nature》上发表了小肠类器官论文的Toshiro Sato当属Clevers最“得意”的博后。不过2011年完成第二篇结直肠癌类器官论文后,Sato选择从荷兰离开并回到了自己的故乡日本,就职于世界顶尖的综合研究型学府 Keio university。
2015年,Sato发表了博后生涯的第三篇《Nature》,探索了Cas 9 基因敲除类器官对肿瘤发生发展的影响。有意思的是,同一时间 Clevers 的另一位高徒 Jarno Drost 同样以一作身份在《Nature》发表了“同款研究”。2016年,基于 HUB 实验室和儿童肿瘤研究中心 Princess Maxima center 的技术平移合作,Drost 出任Princess Maxima 研究员并于2019年主导科研工作。比 Drost 早一年升职的 Sato 则在2018年从助教晋升为教授。
平行于 Sato 和 Drost 在荷兰与日本的足迹,来自美国斯坦福大学 Calvin Kuo 小组的 Akifumi Ootani 事实上2009年也报告了一种培养出肠道类器官的不同策略,但由于后期输出不高,和 Clevers相比 Kuo 组的关注度一直不温不火。
直到 2018年 Kuo 组于《Nature》发表了一篇建设性的文章详细诠释了 PDO 对于重构肿瘤免疫微环境的作用,才真正引起业界注意。与此同时还有两个来自美国的研究小组分别为:MemorialSloan-Kettering Cancer Center 的Chen Yu团队,和Cold Spring Harbor的David Tuveson团队,均基于跟HUB实验室的技术交流合作分别成功开展了前列腺和乳腺类器官的研究。

△ 基因编辑在类器官中的应用
而 Clevers 本人的职业生涯,则沿着大学教授到研究所所长再到HUB实验室负责人的路径,延伸出一些在此之外“企业角色”,值得关注的比如:参与创立了杨森(Crucell),担任罗氏集团位于巴塞尔的药物研究和早期开发主管,联合创立竞争力强劲的再生医学初创公司Surrozen,及以个人身份或HUB实验室名义“战略入伙”遍布全球、专注于类器官技术的新兴生物科技公司,如Epistem、Cellesce、Ocello.BV、Crown Biosciences、STEMCELL Technologies等。
如果纵观大牛们的足迹及其所对应的热点研究,能够从中提炼引申出哪些关于类器官应用和产业前景的重要信息呢?
首先比较明确的是,国际上对类器官的基础研究方向主要集中在肠、肝、肾、胃等消化道器官及其肿瘤组织的培养构建。据统计截至2019年,肠道类器官在全球各类类器官市场中占主导地位对应份额为23.3%,肝脏、胃和胰腺紧随其后,分别为22.5%、19.0%和13.3%。

△ 按器官类型划分的全球类器官市场的市场份额和规模
其次,开创性的培养方法、独创性的发育和疾病模型构建机制是各种类型器官被建立的同时最为热点的研究目的。相应的,用于类器官培养系统的仪器供应和肿瘤组织来源等,自然构成了产业链上游的重要业务。基质胶领域甚至已经形成了由康宁(Corning)收购的BD Biosciences公司Matrigel® 等系列产品的小垄断。STEMCELL 公司和 X cell 公司则主导着类器官细胞培养基和微环境模拟的细分市场。
产业链中游,以提供类器官的培养、冻存建库和传代服务为主。国外代表性的企业包括Ocello.BV、 X cell 和由 Clevers 于2021年最近参与创立的AI加持的类器官技术平台Xills等。而类器官技术的下游,可划分为围绕疾病模型和疗效预测的科研应用层,为中晚期癌症患者提供药敏筛查、精准治疗的临床应用层,和致力于新药研发、拓展适应症的研发应用层。截至2019年,发育生物学在全球类器官应用市场中份额最高达到29%,传染病病理、再生医学、药物毒性与疗效检测、药物发现和个性化医疗等市场份额分别占22.9%、16.6%、14.4%和12.8%。
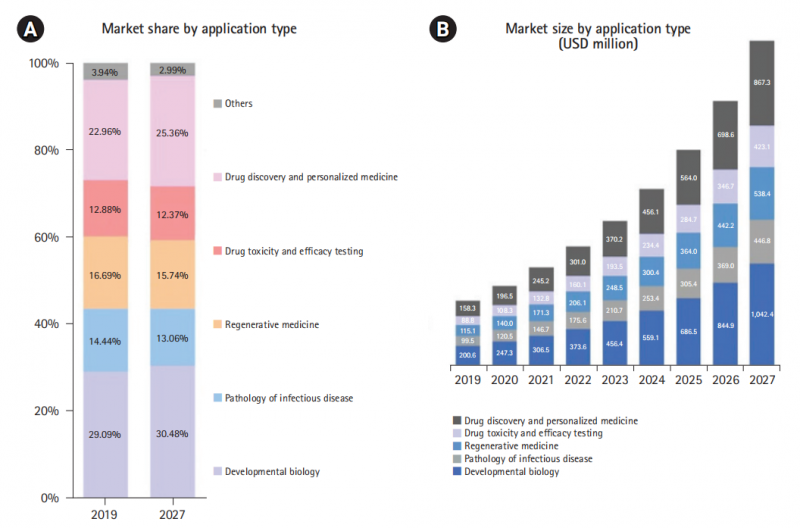
△ 按应用类型划分的类器官全球市场份额和规模
不同于中上游,下游应用层尚未涌现具备完全的商业化落地能力的企业,也侧面反映了类器官作为一项小荷才露尖尖角的新兴技术,依然处于产业化发展的早期阶段。目前来看,未来核心的类器官创新技术聚焦于三个方向:类器官芯片(Organoid-on-a-chip)、AI高通量自动化和类器官样本库。类器官芯片主要运用微流控、3D打印技术以弥补类器官培养中分子信号无法精确调控的缺陷;AI高通量自动化应用于样本质控、培养和使用过程的标准化,提高准确率之余还助力降本增效;样本库的建立则使生理学相关的药物筛选成为可能。
但不论位于产业链的哪个位置,毫无疑问的是,类器官技术本身的高壁垒都要求“进场”者建立拥有自主研发的创新技术,并在类器官培养的各个环节中都掌握独有的know-how。面对如此的挑战和机遇, 全球各国制药和生物科技行业都在争夺同一个布局类器官产业化的窗口期,中国当然不会例外。
04
类器官在中国,
奏响生物经济的号角
近几年, PubMed 公开发表的文献中涉及类器官技术的文献数量呈现直线上升,更显著的是,2020年来自中国地区的数量排名从过去长达近10年间的第六位跃至第二位,仅次于美国。同样地,自2016年起类器官技术被纳入临床试验,截止到2020年9月有63起临床试验于FDA官方备案,而中国自2017年起注册且获批的类器官临床试验研究也达到了20项,涵盖8个癌种。
从基础研究崛起到临床应用的前奏吹响,这期间中国市场发生了什么,又做对了什么?
事实上,一个容易被忽略的视角是,在另一个维度上类器官技术的发展和进步还和干细胞产业化的提速紧密相关。恰好进入2000年后,中国的干细胞产业迎来了新时代的大红利。海外人才的回流、政策的倾斜、资本的护航等几股力量的交织,在很短的时间内助力了以细胞治疗技术为代表的生物创新科技行业的高歌猛进,进而为由各类干细胞来源的类器官技术顺带开辟了一片广阔的“用武之地”。
换句话说,在这样一个历史节点上,我国一批专注于细胞技术的生物科技公司,将凭借在类器官领域的先发优势,迎来细胞创新药之外的另一条充满无限可能的产业化之路。

△ 干细胞培养得到的各种类器官
同年,政策端也针对类器官进一步“松绑”。2021年1月,我国科技部下发的《关于对“十四五”国家重点研发计划6个重点专项2021年度项目申报指南征求意见的通知》中,把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务。
11月,国家药监局药审中心又相继发布《基因治疗产品非临床研究与评价技术指导原则(试行)》、《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》,首次将类器官列入基因治疗及针对基因修饰细胞治疗产品的指导原则当中。
卡在一头一尾的政策东风之间,伴随神十二载人飞船的成功发射,与三位宇航员同步遨游太空的“第四位宇航员”——来自个体内健康和肿瘤组织的 3D 类器官培养物也受到了包括科学界、产业界和普罗大众的关注。

△ 伴随“天和号”核心舱发射成功
“第四位宇航员”肿瘤组织3D类器官培养物进入太空
今年,国家发改委重磅发布的《“十四五”生物经济发展规划》,则在“深化生物经济创新合作”中特别提到:“加快建设人类细胞谱、人类器官生理病理模拟等国家重大科技基础设施”。同时要“加快生物技术赋能健康产业,大力推动基因检测、生物遗传等先进技术与疾病预防深度融合,推动基因组编辑、微流控芯片、细胞制备自动化等先进技术与生物药研发融合,提高临床医疗水平”。
从更大的环境来看,在人口老龄化、肿瘤年轻化,以及新冠疫情持续反复肆虐的“助推”之下,类器官在肿瘤新药研发、个体化医疗、精准医疗和再生医学等领域的应用价值和地位,也将在大健康消费升级的风口里被重新评估。

△ 类器官技术的热点应用领域
而对于整个中国医药业而言,类器官技术的产业化可能并不会经历国产替代的“阵痛之旅”,而是极有希望在全球化的进程中掌握技术主导优势和市场话语权。
华夏源行业研究组 出品
微信ID:SNCgroup
Write in the last
写在最后
2019 年全球类器官市场价值超过17亿美元,并将以21.7%的复合年增长率实现快速扩容。而包括癌症在内的慢性病、传染病发病率和流行率的增加,是类器官作为治疗工具被高度重视和采用的根本驱动。
类器官技术的出现,使我们站在了生命科学发展长河中一个极其重要的历史拐点上,它预示着一个史无前例的机会,那就是可以借助“细胞”的力量,主动参与到生命演化、疾病模拟的过程中使得每一个普通人都有机会从变成主要自己生命旅程的主人,甚至去影响、改变甚至主导未来生命的方向。
这是“类器官”技术的赋予我们最大的可能性。
参考资料:
[1]The Story of Organoids
[2]weinberg.Cell.2011
[3]doi.org/10.1016/j.cell.2016.05.082
[4]10.1038/s41568-018-0007-6
[5]《Nature Reviews Cancer》
[6]doi.org/10.51335/organoid.2021.1.e11
[7]This scientist is building miniature guts, livers, and lungs that could save your life one day
本文仅供读者参考,任何人不得将本文用于非法用途,由此产生的法律后果由使用者自负。
如因文章侵权、图片版权和其它问题请邮件联系,我们会及时处理:tousu_ts@sina.com。
举报邮箱: Jubao@dzmg.cn 投稿邮箱:Tougao@dzmg.cn
未经授权禁止建立镜像,违者将依去追究法律责任
大众商报(大众商业报告)并非新闻媒体,不提供任何新闻采编等相关服务
Copyright ©2012-2023 dzmg.cn.All Rights Reserved
湘ICP备2023001087号-2