华夏源类器官:2024年1月-5月获批消化系统抗肿瘤药物汇总
根据统计数据,在全球范围内,前五种造成患者死亡数量最多的肿瘤中,有3类属于消化系统肿瘤。消化系统的肿瘤包括食管癌、胃癌、结直肠癌、肝细胞瘤、胆道系统肿瘤和胰腺癌等。与其他类型的肿瘤患者相比,消化系统恶性肿瘤的患者生存情况更加令人担忧。
近年来,消化系统肿瘤的治疗突破不断,尤其是以外科手术为核心的综合疗法的发展。同时,在抗肿瘤药物研发方面,一些新药的出现给消化系统肿瘤药物研发领域和患者带来了新的希望。本文对2024年1月-5月上市的消化系统肿瘤新药做依次梳理,以飨读者。
胃癌
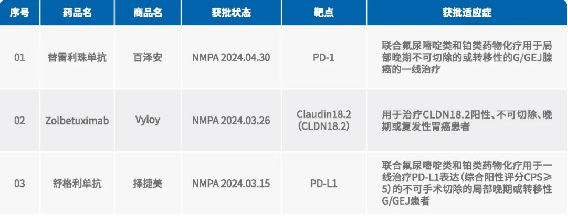
01
替雷利珠单抗
商品名:百泽安
通用名:替雷利珠单抗、Tislelizumab
适应症:G/GEJ
临床试验:RATIONALE-305
原研公司:百济神州
获批日期:2024.04.30
获批机构:NMPA
2024年4月30日,NMPA批准替雷利珠单抗联合氟尿嘧啶类和铂类药物化疗用于局部晚期不可切除的或转移性的G/GEJ腺癌的一线治疗。
至此,替雷利珠单抗已有13项适应症在国内获批,涵盖癌种包括经典型霍奇金淋巴瘤、尿路上皮癌、NSCLC、肝细胞癌(HCC)、实体瘤、食管鳞状细胞癌(ESCC)、鼻咽癌、G/GEJ。
临床数据:
本次获批是基于一项随机、双盲、安慰剂对照的III期临床研究RATIONALE-305(NCT03777657),该研究共纳入997例晚期不可切除或转移性G/GEJ腺癌患者,按照1:1比例随机接受替雷利珠单抗联合化疗(n=501)或安慰剂联合化疗(n=496)治疗。主要研究终点为OS。对PD-L1高人群进行预先指定的分层,随后是ITT人群。
结果显示,PD-L1 TAP平分≥5%的患者使用替雷利珠单抗联合化疗与安慰剂联合化疗相比,总生存期显著改善,中位OS分别为17.2个月和12.6个月,中位PFS分别为7.2个月和5.9个月。
在ITT人群中,替雷利珠单抗组合安慰剂组的OS分别为15.0个月和12.9个月,中位PFS分别为6.9个月和6.2个月。
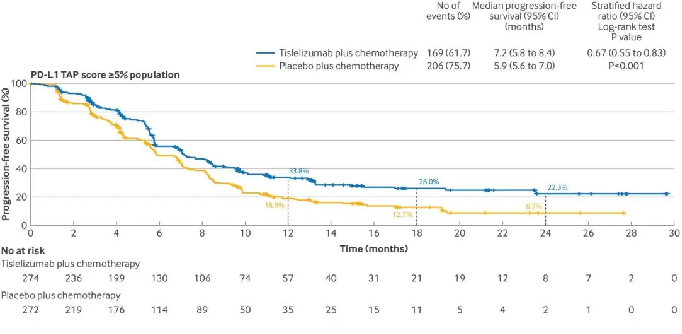
△ 替雷利珠单抗联合化疗对比安慰剂联合化疗在PD-L1 TAP≥5%人群的生存曲线和PFS数据。
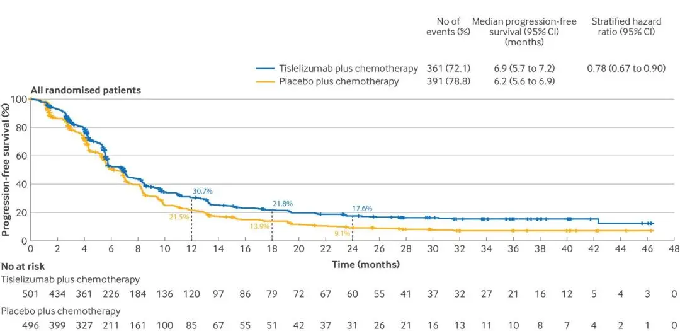
△ 替雷利珠单抗联合化疗对比安慰剂联合化疗在ITT人群的生存曲线和PFS数据。
2023年2月,替雷利珠单抗就已获批用于联合氟尿嘧啶类和铂类药物化疗用于PD-L1高表达的局部晚期不可切除的或转移性的G/GEJ腺癌的一线治疗。本次获批进而验证了无论PD-L1表达如何,替雷利珠单抗联合化疗作为晚期胃癌的一线治疗均可使患者获益。
02
Zolbetuximab
商品名:Vyloy
通用名:Zolbetuximab、佐贝妥昔单抗
适应症:CLDN18.2阳性胃癌
临床试验:SPOTLIGHT、GLOW
原研公司:安斯泰来
获批日期:2024.03.26
获批机构:MHLW
2024年3月26日,MHLW批准Zolbetuximab用于治疗CLDN18.2阳性、不可切除、晚期或复发性胃癌患者。Zolbetuximab成为目前世界首个且唯一被批准的CLDN18.2靶向疗法。
Claudin(CLDN)是正常组织紧密连接中重要的一种蛋白质,具有4个跨膜结构域,它参与细胞旁通透性和电导等过程的调节。
CLDN18.2在包含胃癌在内的消化道癌症中高度表达。因此,CLDN18.2为治疗胃癌、胰腺癌等实体肿瘤的有效靶标。
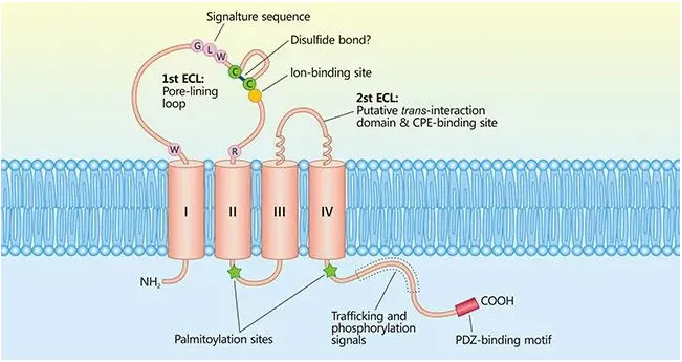
△ Claudin蛋白结构。
Zolbetuximab是一种IgG1单克隆抗体,在肿瘤细胞表面与CLDN18.2特异结合从而发挥抗肿瘤作用。
临床前研究表明,这种结合作用通过激活两种不同的免疫系统途径——抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)诱导癌细胞死亡,以期达到肿瘤治疗的目的。
临床数据:
此次批准基于针对局部晚期不可切除或转移性 HER2 阴性胃或胃食管连接部 (GEJ) 腺癌且肿瘤为 CLDN18.2 阳性的患者进行一线治疗的3 期SPOTLIGHT(NCT03504397)和GLOW(NCT03653507)临床试验的结果。
SPOTLIGHT是一项全球、多中心、双盲、随机III期研究,GLOW(封闭招募)是一项全球、双盲、3 期研究,与 SPOTLIGHT 同时进行,以确认在一线治疗环境中在化疗中添加佐尔贝妥昔单抗的疗效。
SPOTLIGHT试验结果显示,接受Zolbetuximab与mFOLFOX6(一种包含奥沙利铂、亚叶酸钙和氟尿嘧啶的联合化疗方案)组合治疗患者的PFS与OS在统计上有明显改善。
Zolbetuximab组和安慰剂组的PFS分别为10.61个月和8.67个月,OS分别为18.23个月和15.54个月。与安慰剂组相比,Zolbetuximab组患者的疾病进展与死亡风险显著降低24.9%,达成试验主要终点。
GLOW试验结果显示,接受Zolbetuximab与CAPOX(一种包括卡培他滨和奥沙利铂的联合化疗方案)组合疗法患者的PFS在统计上显著改善。Zolbetuximab组和安慰剂组的PFS分别为8.21个月和6.8个月。与安慰剂组相比,组合疗法可降低患者疾病进展或死亡风险达31.3%。此外,组合疗法还显著延长患者的OS(试验的关键次要终点),两组OS分别为14.39个月和12.16个月,降低患者的死亡风险达22.9%。
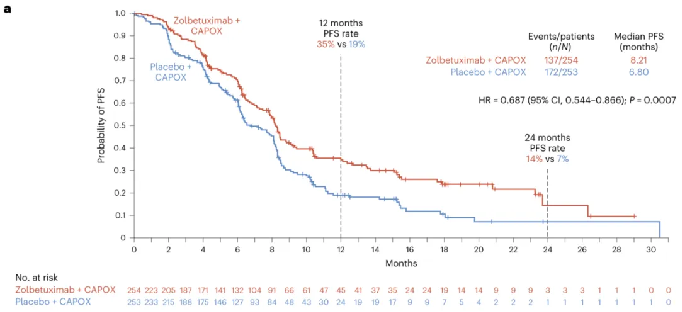
△ GLOW试验中患者的PF。S结果。

△ GLOW试验中患者的OS结果。
Zolbetuximab与mFOLFOX6或CAPOX联用最常见的(≥20%)治疗伴发不良反应(TEAE)是恶心、呕吐、食欲下降、中性粒细胞减少和体重减轻。在临床试验中,不良反应可通过止吐药、剂量中断和输注速度调整来控制。
03
舒格利单抗
商品名:择捷美
通用名:舒格利单抗、Sugemalimab
适应症:PD-L1表达(CPS≥5)G/GEJ
临床试验:GEMSTONE-303
原研公司:基石药业
获批日期:2024.03.15
获批机构:NMPA
2024年3月15日,NMPA批准舒格利单抗联合氟尿嘧啶类和铂类药物化疗用于一线治疗PD-L1表达(综合阳性评分CPS≥5)的不可手术切除的局部晚期或转移性G/GEJ患者。这是NMPA批准舒格利单抗的第五项适应症。
临床数据:
本次获批是基于一项多中心、随机、双盲、安慰剂对照的III期临床研究GEMSTONE-303,该研究旨在评估舒格利单抗联合奥沙利铂和卡培他滨作为一线治疗无法手术切除的PD-L1表达(CPS≥5)的局部晚期或转移性G/GEJ的疗效和安全性。试验的主要研究终点为研究者评估的PFS和OS。该研究是目前首个使用PD-L1单抗达成PFS和OS双终点阳性的临床研究。
结果显示,舒格利单抗组对比安慰剂组在双主要终点均有显著改善,达到PFS和OS双终点阳性且安全性良好可耐受。
PFS数据显示,舒格利单抗组对比安慰剂组的中位PFS显著改善,由研究者评估的中位PFS分别为7.6个月和6.1个月,降低34%疾病进展或死亡风险。PFS亚组分析显示各亚组一致获益,其中在PD-L1 CPS≥10的人群中,PFS获益更显著,PFS分别为7.79个月和5.52个。
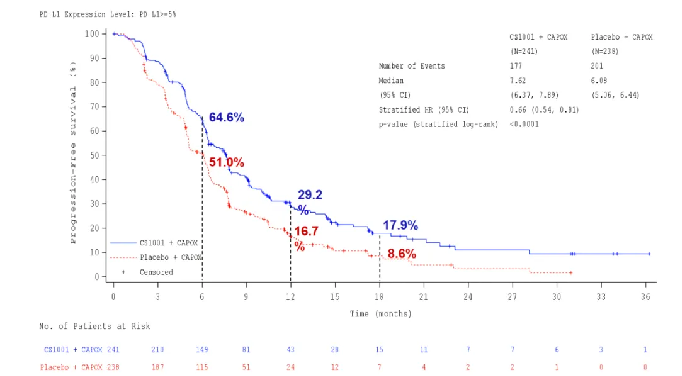
△ PD-L1 CPS≥5人群的PFS获益结果。
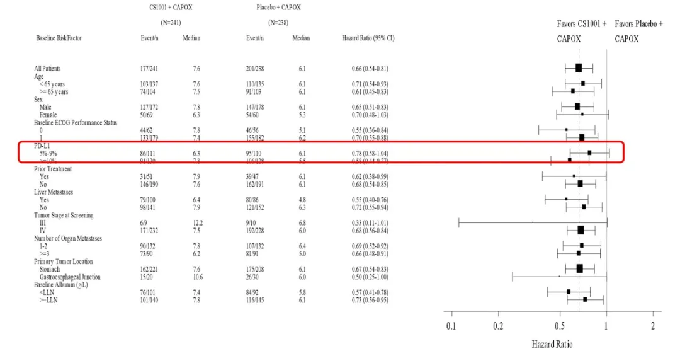
△ PFS亚组分析结果。
OS数据显示,舒格利单抗组对比安慰剂组的中位OS延长近3个月,分别为15.6个月和12.6个月,降低死亡风险25%,其中,PD-L1 CPS≥10人群的OS获益更显著,中位OS延长5个多月,分别为17.81个月和12.45个月,降低死亡风险36%。此外,两组12个月OS率分别为61.25%和52.02%,24个月OS率分别为29.9%和23.28%。
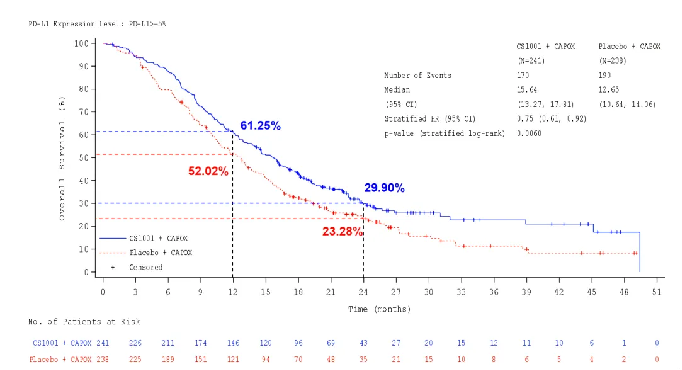
△ PD-L1 CPS≥5人群的OS获益结果。
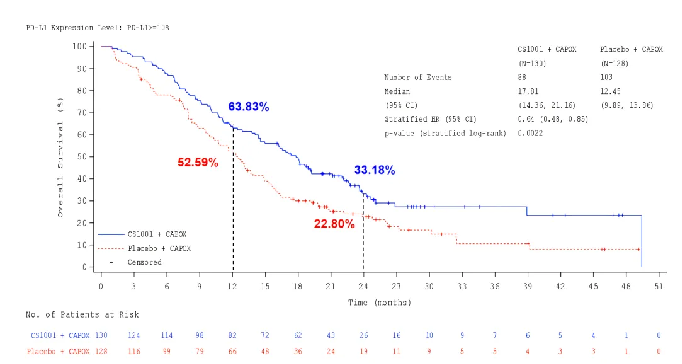
△ PD-L1 CPS≥10人群的OS获益结果。
次要终点方面,舒格利单抗组与安慰剂组的ORR分别为68.6%和52.7%,其中,PD-L1 CPS≥10人群的ORR高达71.4%。中位DoR分别为6.87个月和4.63个月,舒格利单抗组可为晚期胃癌患者带来更深程度的肿瘤缓解。
安全性方面,舒格利单抗组对比安慰剂组的3-5级相关AE的发生率分别为31.1%和28.7%,未观察到新的安全信号,整体安全可耐受。
食管鳞状细胞癌(ESCC)

01
替雷利珠单抗
商品名:百泽安
通用名:替雷利珠单抗、Tislelizumab
适应症:ESCC
临床试验:RATIONALE 302
原研公司:百济神州
获批日期:2024.03.15
获批机构:FDA
2024年3月15日,替雷利珠单抗获FDA批准,作为单药治疗既往接受过系统化疗(不含PD-1/L1抑制剂)后不可切除或转移性ESCC成人患者。此次获批标志着替雷利珠单抗在美国获批首个适应症。
临床数据:
本次获批是基于一项全球、随机、开放性的III期临床研究RATIONALE 302(NCT03430843),该研究旨在比较替雷利珠单抗单药和研究者选择的化疗在不可切除、局部晚期或转移性ESCC患者二线治疗时的有效性和安全性。
结果显示,替雷利珠单抗与化疗相比显著改善了患者的OS,中位OS分别为8.6个月和6.3个月。替雷利珠单抗组的6个月OS率为62.3%,化疗组为51.8%;12个月OS率分别为37.4%和23.7%。在PD-L1表达≥10%人群中,替雷利珠单抗的总生存期更是达到了10.3个月。
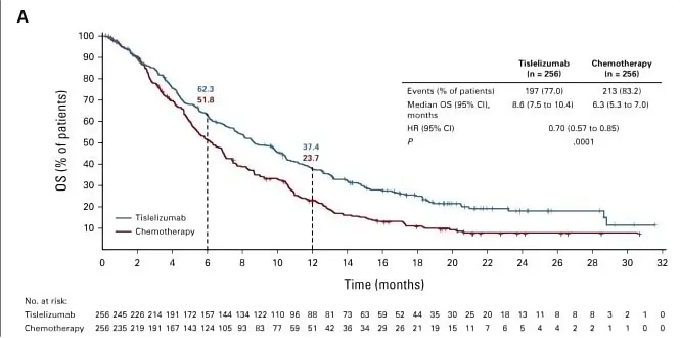
△ ITT人群的OS获益结果。
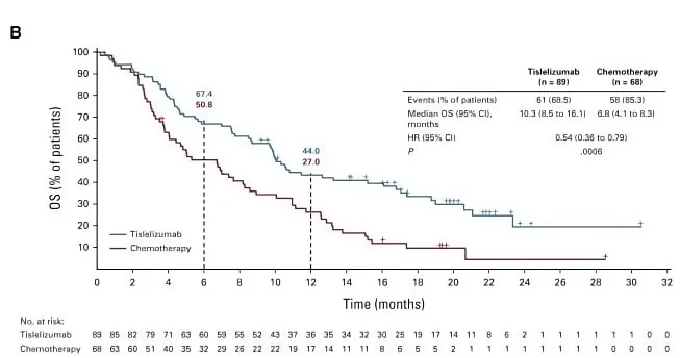
△ PD-L1 TAP≥10%人群的OS获益结果。
肝细胞癌(HCC)

01
替雷利珠单抗
商品名:百泽安
通用名:替雷利珠单抗、Tislelizumab
适应症:HCC
临床试验:RATIONALE 301
原研公司:百济神州
获批日期:2024.01.02
获批机构:NMPA
2024年1月2日,替雷利珠单抗已正式获批用于一线治疗不可切除或转移性HCC患者。截至目前,替雷利珠单抗已有13项适应症获得NMPA批准,是目前在中国获批适应症数量最多的PD-1抑制剂,涵盖NSCLC、经典型霍奇金淋巴瘤、尿路上皮癌、HCC、食管鳞状细胞癌、鼻咽癌、胃或胃食管结合部(G/GEJ)腺癌等癌种。
临床数据:
此次获批是基于RATIONALE 301研究( NCT03412773)的临床试验数据。该研究也是国际上首个获得预期的阳性结果的替雷利珠单抗一线治疗晚期不可切除肝细胞癌患者的前瞻性、随机对照、关键性III期临床试验,旨在评估替雷利珠单抗相比与晚期HCC标准一线治疗药物索拉非尼的有效性和安全性,主要终点为两个治疗组OS的非劣效比较。
结果显示,替雷利珠单抗与索拉非尼相比达到了预设的主要研究终点,即OS为非劣效性。替雷利珠单抗组的中位OS为15.9个月,而索拉非尼组的中位OS为14.1个月,死亡风险降低了15%,mOS延长了1.8个月,具有生存获益的趋势。
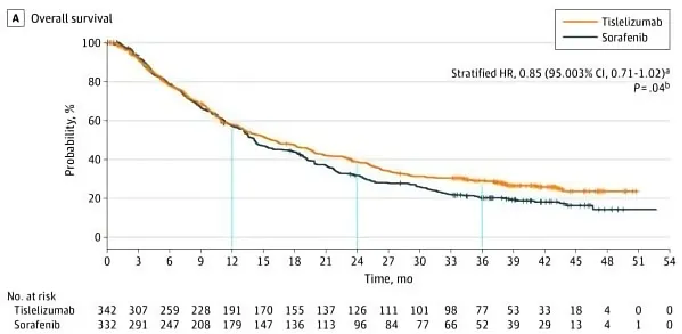
△ RATIONALE 301研究OS结果。
在肿瘤缓解方面,替雷利珠单抗组的ORR为14.3%,其中有将近3%的患者(10例)获得了肿瘤完全缓解(CR),而索拉非尼组的ORR仅为5.4%。更为可喜的是,在DOR方面,替雷利珠单抗显示出明显的优势,中位DOR达到了36.1个月。
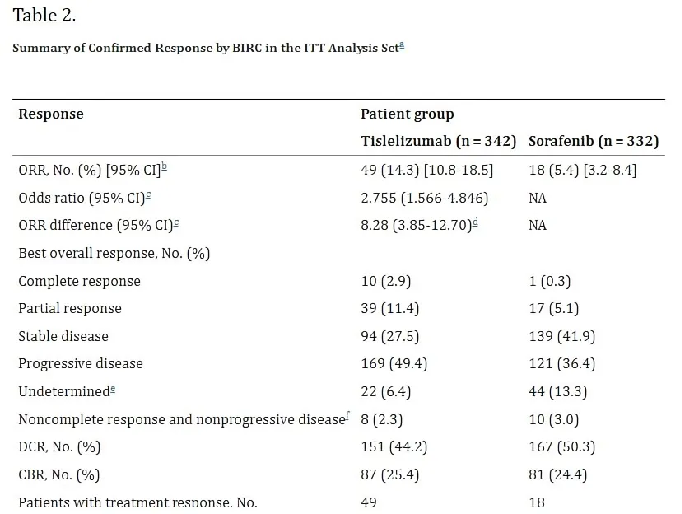
△ RATIONALE 301研究临床数据。
胆道癌(BTC)

01
帕博利珠单抗
商品名:可瑞达、Keytruda
通用名:帕博利珠单抗、Pembrolizumab
适应症:BTC
临床试验:KEYNOTE-966
原研公司:默沙东
获批日期:2024.02.04
获批机构:NMPA
2024年2月4日,帕博利珠单抗获批用于联合吉西他滨和顺铂用于局部晚期或转移性BTC患者的一线治疗。这是在中国获批上市以来,帕博利珠单抗在国内获批的第13项适应证。
临床数据:
该适应证的获批基于KEYNOTE-966研究(NCT04003636)结果。KEYNOTE-966为一项国际多中心、随机、安慰剂对照的III期临床研究,旨在评估帕博利珠单抗联合吉西他滨/顺铂对比安慰剂联合吉西他滨/顺铂治疗既往未接受过系统治疗的晚期BTC成人患者的疗效和安全性,是首个程序性死亡受体1抑制剂的安慰剂对照研究,也是有关程序性死亡受体1或其配体检查点抑制剂显著改善晚期胆道恶性肿瘤患者总生存期且安全性可控的第2个研究。
结果显示,中位随访29.5个月时,帕博利珠单抗组和安慰剂组的中位OS分别为12.7个月和10.9个月,存在显著差异。两组的12个月OS率分别为52%和44%,24个月OS率分别为25%和19%。两组的中位PFS分别为6.5个月和5.6个月,中位DoR分别为8.3个月和6.9个月,ORR分别为28.9%和28.5%。帕博利珠组和安慰剂组发生3、4级AE分别为79%和75%,总体上,帕博利珠单抗联合化疗治疗BTC安全性良好。
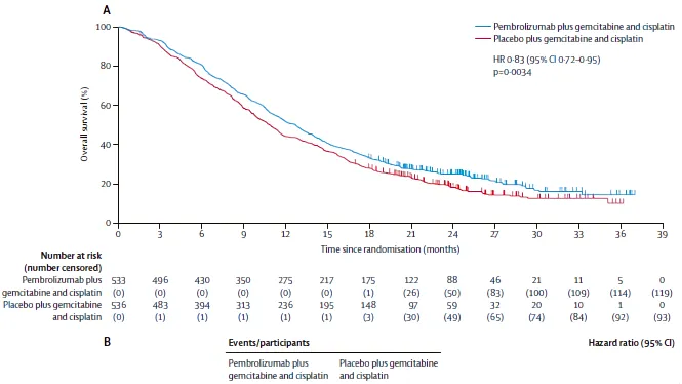
△ KEYNOTE-966研究OS数据。
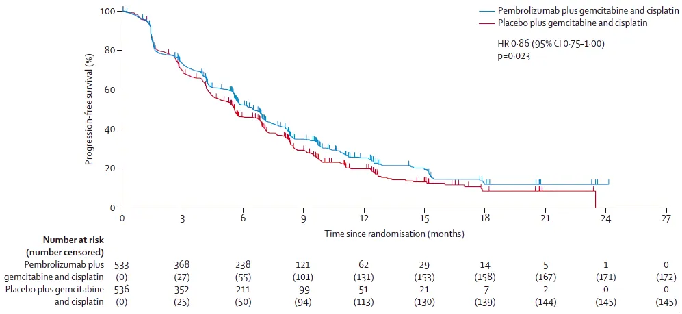
△ KEYNOTE-966研究PFS数据。
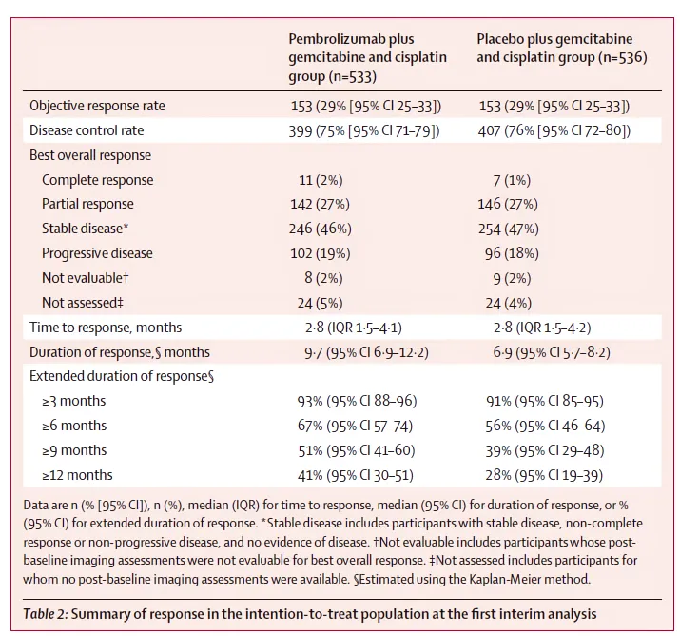
△ KEYNOTE-966研究临床数据。
2024年1月至5月期间,消化系统肿瘤药物的研究和开发取得了显著进展,这些进展不仅包括了新药的发现和临床试验结果,还涵盖了治疗方法的创新和药物使用的优化。
这些进展的意义在于,它们不仅提高了消化系统肿瘤的治疗效果,还促进了个性化和精准医疗的发展,同时也推动了全球肿瘤研究的合作与交流。
随着新药的不断研发和治疗方法的创新,患者的生存率和生活质量有望得到进一步提高。
本文仅供读者参考,任何人不得将本文用于非法用途,由此产生的法律后果由使用者自负。如因文章侵权、图片版权和其它问题请邮件联系,我们会及时处理:tousu_ts@sina.com。
举报邮箱: Jubao@dzmg.cn 投稿邮箱:Tougao@dzmg.cn
未经授权禁止建立镜像,违者将依去追究法律责任
大众商报(大众商业报告)并非新闻媒体,不提供任何新闻采编等相关服务
Copyright ©2012-2023 dzmg.cn.All Rights Reserved
湘ICP备2023001087号-2